O QUE É E COMO FUNCIONA?
Richard Baxter, Jim Britton
Como o aço é corroído na água do mar?
Para entender a proteção catódica primeiro é preciso entender o mecanismo da corrosão. Para que a corrosão ocorra, três condições devem estar presentes.1. Dois metais diferentes
2. Um eletrólito (água com qualquer tipo de sal ou sais dissolvidos nela)
3. Um caminho metálico (condutivo) entre os metais diferentes
Os dois metais diferentes podem ser ligas totalmente diferentes como aço e alumínio, mas mais frequentemente são diferenças metalúrgicas micro ou macroscópicas na superfície de uma peça única de aço. Se as condições acima existirem, na superfície metálica mais ativa (nesse caso consideraremos o aço sendo corroído livremente, o que não é uniforme), ocorre a seguinte reação nos locais mais ativos: (2 íons de ferro mais 4 elétrons livres)
2Fe => 2Fe++ + 4e-
Os elétrons livres viajam pelo caminho metálico até os locais menos ativos em que ocorre a seguinte reação: (O gás oxigênio convertido em íons de oxigênio – através da combinação com os quatro elétrons livres – que se combinam com a água para formar íons de hidroxila)O2 + 4e- + 2H20 => 4 OH-
As recombinações desses íons na superfície ativa produzem a seguinte reação, que gera o produto corrosivo de ferro, o hidróxido ferroso (Ferro combinando com oxigênio e água para formar hidróxido ferroso):2Fe + O2 + 2H2O => 2Fe (OH)2
Essa reação é mais comumente explicada como um fluxo de corrente através da água do anodo (local mais ativo) para o catodo (local menos ativo).Como a proteção catódica interrompe a corrosão?
A proteção catódica impede a corrosão convertendo todos os locais anódicos (ativos) da superfície do metal em locais catódicos (passivos) fornecendo uma corrente elétrica (ou elétrons livres) de uma fonte alternativa.Geralmente isso toma a forma de anodos galvânicos, que são mais ativos do que o aço. Essa prática também é chamada de sistema sacrificial, pois os anodos galvânicos sacrificam a si mesmos para proteger o aço estrutural ou a tubulação contra a corrosão.
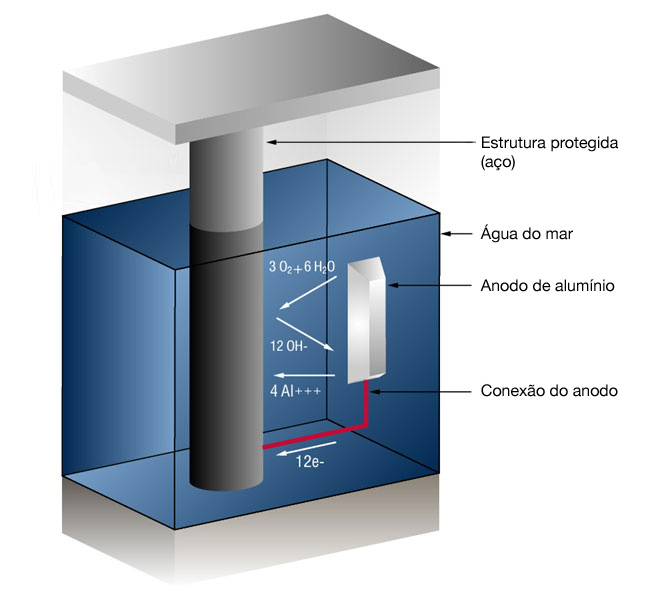
No caso de anodos de alumínio, a reação na superfície do alumínio é (4 íons de alumínio mais 12 elétrons livres):
4Al => 4AL+++ + 12 e-
e na superfície do aço (O gás oxigênio convertido em íons de oxigênio que se combina com a água para formar íons de hidroxila):3O2 + 12e- + 6H20 => 12OH-
Desde que a corrente (elétrons livres) esteja chegando no cátodo (aço) mais rápido do que o oxigênio está chegando, não ocorre corrosão.Figura 1: Sistema de PC de anodo de sacrifício em água do mar

Considerações básicas ao se indicar sistemas de anodo de sacrifício
A corrente elétrica que um anodo descarrega é controlada pela lei de Ohm, isto é:I=E/R
Onde: I= Fluxo de corrente em Ampère
E= Diferença de potencial entre o anodo e o cátodo em volts
R= Resistência total do circuito em ohms
Inicialmente a corrente será alta devido porque a diferença de potencial entre o anodo e o cátodo é alta, mas conforme a diferença de potencial diminui devido ao efeito do fluxo de corrente sobre o cátodo, a corrente diminui gradualmente devido à polarização do cátodo. A resistência do circuito inclui o caminho da água e o caminho do metal, incluindo qualquer cabo do circuito. O valor dominante aqui é a resistência do anodo com a água do mar.
Para a maioria das aplicações a resistência do metal é tão pequena comparada à resistência da água do mar que pode ser ignorada. (Não verdadeiro para trilhos ou tubulações longas protegidas nas duas extremidades). Em geral, anodos longos e finos têm menor resistência do que anodos curtos e grossos. Eles descarregarão mais corrente, mas não durarão muito tempo. Portanto o projetista da proteção catódica deve dimensionar os anodos de modo que eles tenham o formato e a área de superfície corretos para descarregar corrente suficiente para proteger a estrutura e peso suficiente para durar o tempo desejado ao descarregar essa corrente.
Como regra prática: Comprimento do anodo determina quanta corrente ele pode produzir e consequentemente, quantos metros quadrados de aço podem ser protegidos. Seção transversal (Peso) determina por quanto tempo o anodo pode sustentar esse nível de proteção.
Sistemas de proteção catódica de corrente impressa
Devido às altas correntes envolvidas em muitos sistemas em água do mar, não é incomum usar sistemas de corrente impressa. Os sistemas de corrente impressa usam anodos de um tipo que não se dissolve facilmente em íons metálicos, mas sustentam uma reação alternativa, a oxidação dos íons de cloreto dissolvidos.2Cl- => Cl2 + 2e-
A energia é fornecida por uma unidade de alimentação CC externa.Figura 2: Sistema de proteção catódica de corrente impressa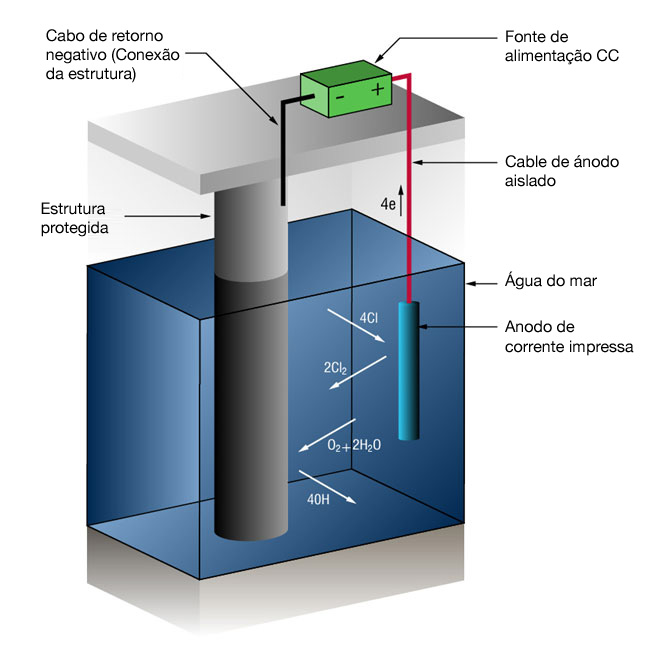

Como sabemos quando temos proteção catódica suficiente?
Sabemos se temos ou não corrente suficiente medindo o potencial do aço contra um eletrodo de referência padrão, geralmente prata/cloreto de prata (Ag/AgCl sw.), mas algumas vezes, zinco (Zn sw.). O fluxo de corrente em qualquer metal muda seu potencial normal na direção negativa. A história mostra que se o aço receber corrente suficiente para mudar o potencial para (-) 0,800 V x prata/cloreto de prata, a corrosão é essencialmente interrompida.Devido à natureza dos filmes formados, o potencial mínimo (-0,800 V) raramente é o potencial ideal e os projetistas tentam alcançar um potencial entre (-) 0,950 V e (-) 1.000 V x Prata/Cloreto de prata sw.
Figura 3: Medição do potencial de proteção catódica (Esquerdo desprotegido – Direito protegido)
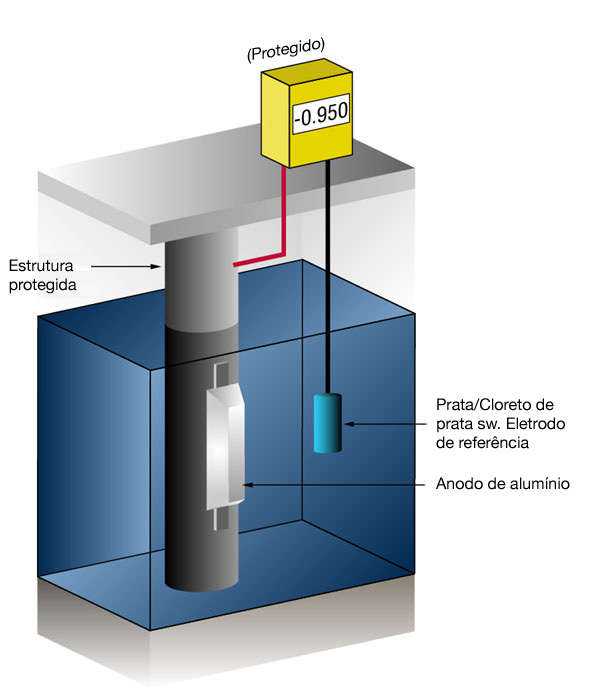 | 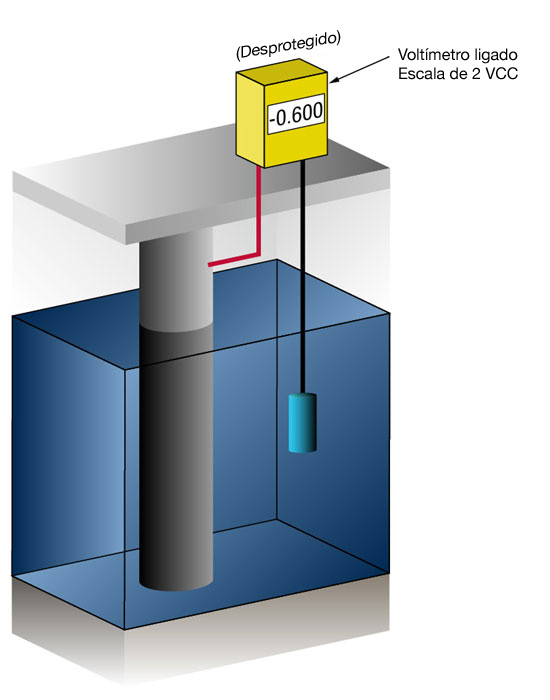 |
Nenhum comentário:
Postar um comentário